Per analizzare i processi di espansione adiabatica del vapore, invece dell'approccio numerico, è possibile adottarne uno di tipo grafico che si basa sull'uso del diagramma di Mollier.
Questo diagramma concentra una moltitudine di informazioni: proprio per questo appare di una certa complessità e al primo impatto molte persone rinunciano alla sua comprensione e al suo utilizzo.
Per agevolarne la comprensione è stato scelto di mostrare la costruzione in vari passaggi di una sua versione semplificata in cui sono riportate solo le curve di interesse.
Il diagramma di Mollier è costruito sul piano H-S, cioè l'entalpia viene graficata in funzione dell'entropia.
Senza entrare nel dettaglio del significato fisico dell'entropia, non necessaria ai fini dell'utilizzo del diagramma, al lettore è sufficiente sapere che una trasformazione adiabatica (e più precisamente adiabatica reversibile) è una trasformazione di tipo isoentropico, cioè a entropia costante. Questo vuol dire che nel piano H-S l'adiabatica viene rappresentata con un tratto lineare verticale.
Per quanto concerne l'entalpia si rimanda a quanto già scritto fermo restando che per i contenuti trattati in questo post risulta di secondaria importanza. Verrà ripreso e spiegato estesamente come interpretarla al momento opportuno in altri scritti.
Nell'immagine che segue sono stati graficati i valori dell'entalpia in funzione dell'entropia relativi allo stato liquido e allo stato di vapore saturo.
La curva blu mostra l'andamento dello stato liquido per pressioni da 0,1bar fino alla pressione critica, la curva rossa mostra l'andamento dello stato di vapore saturo dalla pressione critica fino alla pressione di 0,1bar.
Queste due curve separano due zone del piano. Al di sopra delle curve si trovano i punti che rappresentano stati di vapore surriscaldato. Al di sotto delle curve è localizzata la zona di coesistenza del liquido con la fase di vapore saturo.
Si noti che nel punto a 0,1 bar della curva blu la frazione condensata è pari al 100%, cioè è presente la sola fase liquida.
La frazione condensata è invariata (cioè è sempre pari al 100%) per tutta l'estensione della curva blu fino al punto critico.
Nel punto critico perde di significato la distinzione fra liquido e vapore.
La curva rossa è relativa allo stato di vapore saturo in cui è assente la fase liquida: la frazione condensata è pari allo 0%.
Anche se il valore della frazione condensata nella curva del vapore è stato indicato solo nel punto in cui la pressione è pari a 0,1bar essa risulta invariata (cioè sempre pari allo 0%) per tutta l'estensione della curva rossa.
Nell'immagine che segue è stata aggiunta la curva che descrive la trasformazione isobara a 10bar che parte dallo stato liquido alla temperatura di 179,9°C (temperatura di vaporizzazione a 10bar) per arrivare allo stato di vapore surriscaldato alla pressione di 10bar e alla temperatura di 550°C.
Il tratto di curva di colore fucsia rappresenta il processo di vaporizzazione che avviene a pressione costante (10bar) e temperatura costante (179,9°C).
Quando il sistema si trova in uno dei punti di questa curva sono presenti sia il liquido che il vapore saturo. Le linee nere rappresentano stati a frazione condensata costante (il valore di quest'ultima è indicato in prossimità del punto di inizio della curva).
Il tratto di curva di colore celeste rappresenta il processo di surriscaldamento isobaro a 10bar da 179,9°C a 550°C.
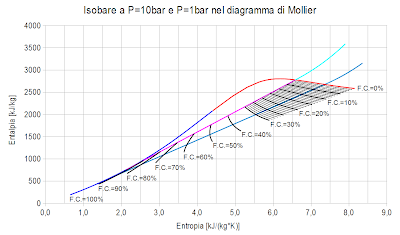
Nell'immagine che segue è stata aggiunta la curva che rappresenta l'isobara alla pressione di 1bar (curva di colore blu chiaro).
Si noti che le due curve isobare scelte sono le stesse adottate negli esempi proposti per il ciclo Rankine del vapore saturo e per il ciclo Rankine del vapore surriscaldato.
Ipotizzando che lo stato di partenza dell'espansione adiabatica sia il vapore saturo a 10bar e che l'espansione adiabatica avvenga fino alla pressione di 1 bar, la trasformazione è quella rappresentata dalla linea gialla verticale.
Per stabilire la frazione condensata si valuta guardando sulle curve nere qual è il valore che più si avvicina alla intersezione fra la linea verticale gialla (adiabatica) e la curva blu chiaro (isobara a 1 bar). Cliccando sul grafico è possibile visualizzare un'immagine a risoluzione più elevata.
Si trova che il valore della frazione condensata è prossimo al 13% in perfetto accordo con quanto calcolato nel post intitolato "L'espansione adiabatica del vapore saturo - Episodio 02".
L'ultima immagine proposta è relativa ad un'espansione adiabatica in cui lo stato iniziale è il vapore a 10bar surriscaldato a 370°C.
In questo caso, l'intersezione fra la curva gialla e la curva blu chiaro avviene in corrispondenza della curva rossa: lo stato finale è quello del vapore saturo a 1bar in cui la frazione condensata è assente.
Detto in altre parole, la costruzione in figura mostra che l'espansione adiabatica del vapore da 10bar e 370°C fino a 1bar avviene senza processi di condensazione perchè il regime di saturazione viene raggiunto solo alla fine dell'espansione.
Questo diagramma concentra una moltitudine di informazioni: proprio per questo appare di una certa complessità e al primo impatto molte persone rinunciano alla sua comprensione e al suo utilizzo.
Per agevolarne la comprensione è stato scelto di mostrare la costruzione in vari passaggi di una sua versione semplificata in cui sono riportate solo le curve di interesse.
Il diagramma di Mollier è costruito sul piano H-S, cioè l'entalpia viene graficata in funzione dell'entropia.
Senza entrare nel dettaglio del significato fisico dell'entropia, non necessaria ai fini dell'utilizzo del diagramma, al lettore è sufficiente sapere che una trasformazione adiabatica (e più precisamente adiabatica reversibile) è una trasformazione di tipo isoentropico, cioè a entropia costante. Questo vuol dire che nel piano H-S l'adiabatica viene rappresentata con un tratto lineare verticale.
Per quanto concerne l'entalpia si rimanda a quanto già scritto fermo restando che per i contenuti trattati in questo post risulta di secondaria importanza. Verrà ripreso e spiegato estesamente come interpretarla al momento opportuno in altri scritti.
Nell'immagine che segue sono stati graficati i valori dell'entalpia in funzione dell'entropia relativi allo stato liquido e allo stato di vapore saturo.
La curva blu mostra l'andamento dello stato liquido per pressioni da 0,1bar fino alla pressione critica, la curva rossa mostra l'andamento dello stato di vapore saturo dalla pressione critica fino alla pressione di 0,1bar.
Queste due curve separano due zone del piano. Al di sopra delle curve si trovano i punti che rappresentano stati di vapore surriscaldato. Al di sotto delle curve è localizzata la zona di coesistenza del liquido con la fase di vapore saturo.
Si noti che nel punto a 0,1 bar della curva blu la frazione condensata è pari al 100%, cioè è presente la sola fase liquida.
La frazione condensata è invariata (cioè è sempre pari al 100%) per tutta l'estensione della curva blu fino al punto critico.
Nel punto critico perde di significato la distinzione fra liquido e vapore.
La curva rossa è relativa allo stato di vapore saturo in cui è assente la fase liquida: la frazione condensata è pari allo 0%.
Anche se il valore della frazione condensata nella curva del vapore è stato indicato solo nel punto in cui la pressione è pari a 0,1bar essa risulta invariata (cioè sempre pari allo 0%) per tutta l'estensione della curva rossa.
Nell'immagine che segue è stata aggiunta la curva che descrive la trasformazione isobara a 10bar che parte dallo stato liquido alla temperatura di 179,9°C (temperatura di vaporizzazione a 10bar) per arrivare allo stato di vapore surriscaldato alla pressione di 10bar e alla temperatura di 550°C.
Il tratto di curva di colore fucsia rappresenta il processo di vaporizzazione che avviene a pressione costante (10bar) e temperatura costante (179,9°C).
Quando il sistema si trova in uno dei punti di questa curva sono presenti sia il liquido che il vapore saturo. Le linee nere rappresentano stati a frazione condensata costante (il valore di quest'ultima è indicato in prossimità del punto di inizio della curva).
Il tratto di curva di colore celeste rappresenta il processo di surriscaldamento isobaro a 10bar da 179,9°C a 550°C.
Nell'immagine che segue è stata aggiunta la curva che rappresenta l'isobara alla pressione di 1bar (curva di colore blu chiaro).
Si noti che le due curve isobare scelte sono le stesse adottate negli esempi proposti per il ciclo Rankine del vapore saturo e per il ciclo Rankine del vapore surriscaldato.
Ipotizzando che lo stato di partenza dell'espansione adiabatica sia il vapore saturo a 10bar e che l'espansione adiabatica avvenga fino alla pressione di 1 bar, la trasformazione è quella rappresentata dalla linea gialla verticale.
Per stabilire la frazione condensata si valuta guardando sulle curve nere qual è il valore che più si avvicina alla intersezione fra la linea verticale gialla (adiabatica) e la curva blu chiaro (isobara a 1 bar). Cliccando sul grafico è possibile visualizzare un'immagine a risoluzione più elevata.
Si trova che il valore della frazione condensata è prossimo al 13% in perfetto accordo con quanto calcolato nel post intitolato "L'espansione adiabatica del vapore saturo - Episodio 02".
L'ultima immagine proposta è relativa ad un'espansione adiabatica in cui lo stato iniziale è il vapore a 10bar surriscaldato a 370°C.
In questo caso, l'intersezione fra la curva gialla e la curva blu chiaro avviene in corrispondenza della curva rossa: lo stato finale è quello del vapore saturo a 1bar in cui la frazione condensata è assente.
Detto in altre parole, la costruzione in figura mostra che l'espansione adiabatica del vapore da 10bar e 370°C fino a 1bar avviene senza processi di condensazione perchè il regime di saturazione viene raggiunto solo alla fine dell'espansione.