Un gas compie una trasformazione isoterma quando fa o subisce lavoro di volume ricevendo o dissipando calore in modo da mantenere invariata la temperatura.
Quando un gas compie un'espansione effettuando perciò lavoro di volume, il volume aumenta mentre la pressione e la temperatura diminuiscono.
Fornendo calore dall'esterno si può impedire la variazione della temperatura, ma la pressione cala comunque anche se di una minore entità rispetto al caso in cui la temperatura non viene mantenuta costante.
Quando un gas viene compresso subendo perciò del lavoro di volume, il volume diminuisce mentre la pressione e la temperatura aumentano.
Dissipando calore verso l'esterno si può impedire la variazione della temperatura, ma la pressione cresce comunque anche se di una minore entità rispetto al caso in cui la temperatura non viene mantenuta costante.
In pratica, una trasformazione isoterma con immissione di calore è un'espansione a temperatura costante e al tempo stesso una depressurizzazione a temperatura costante; una trasformazione isoterma con perdita di calore è una compressione a temperatura costante e al tempo stesso una pressurizzazione a temperatura costante.
A parità di calore scambiato, la variazione di volume e di pressione non dipende dal tipo di gas, ma solo dai valori iniziali di P e V e dalla quantità di gas secondo le seguenti relazioni
Variazione di Volume = Vfinale - Viniziale = Viniziale * { e [ Q / ( n * R * T ) ] - 1 }
Variazione di Pressione = Pfinale - Piniziale = Piniziale * { e [ - Q / ( n * R * T ) ] - 1 }
in cui
Vfinale è il volume alla fine della trasformazione espresso in m3
Viniziale è il volume all'inizio della trasformazione espresso in m3
Pfinale è la pressione alla fine della trasformazione espressa in Pa
Piniziale è la pressione all'inizio della trasformazione espressa in Pa
Q è il calore scambiato espresso in J: un valore di Q positivo indica calore fornito al gas, un valore di Q negativo indica calore ceduto dal gas
n è la quantità di gas espressa in moli
R è la costante dei gas perfetti (R = 8,314 J mol-1 K-1)
T è la temperatura a cui avviene la trasformazione espressa in K
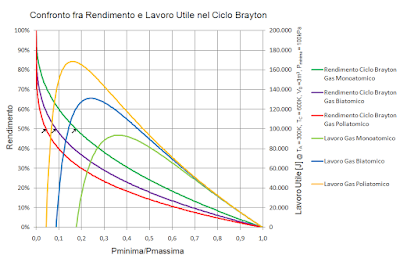
Di seguito sono stati graficati i salti volumetrici e pressori in funzione del calore scambiato.
I valori sono riferiti a 1m3 di gas a T=300K, P=100kPa, n=40,09mol.
Quando un gas compie un'espansione effettuando perciò lavoro di volume, il volume aumenta mentre la pressione e la temperatura diminuiscono.
Fornendo calore dall'esterno si può impedire la variazione della temperatura, ma la pressione cala comunque anche se di una minore entità rispetto al caso in cui la temperatura non viene mantenuta costante.
Quando un gas viene compresso subendo perciò del lavoro di volume, il volume diminuisce mentre la pressione e la temperatura aumentano.
Dissipando calore verso l'esterno si può impedire la variazione della temperatura, ma la pressione cresce comunque anche se di una minore entità rispetto al caso in cui la temperatura non viene mantenuta costante.
In pratica, una trasformazione isoterma con immissione di calore è un'espansione a temperatura costante e al tempo stesso una depressurizzazione a temperatura costante; una trasformazione isoterma con perdita di calore è una compressione a temperatura costante e al tempo stesso una pressurizzazione a temperatura costante.
A parità di calore scambiato, la variazione di volume e di pressione non dipende dal tipo di gas, ma solo dai valori iniziali di P e V e dalla quantità di gas secondo le seguenti relazioni
Variazione di Volume = Vfinale - Viniziale = Viniziale * { e [ Q / ( n * R * T ) ] - 1 }
Variazione di Pressione = Pfinale - Piniziale = Piniziale * { e [ - Q / ( n * R * T ) ] - 1 }
in cui
Vfinale è il volume alla fine della trasformazione espresso in m3
Viniziale è il volume all'inizio della trasformazione espresso in m3
Pfinale è la pressione alla fine della trasformazione espressa in Pa
Piniziale è la pressione all'inizio della trasformazione espressa in Pa
Q è il calore scambiato espresso in J: un valore di Q positivo indica calore fornito al gas, un valore di Q negativo indica calore ceduto dal gas
n è la quantità di gas espressa in moli
R è la costante dei gas perfetti (R = 8,314 J mol-1 K-1)
T è la temperatura a cui avviene la trasformazione espressa in K
Di seguito sono stati graficati i salti volumetrici e pressori in funzione del calore scambiato.
I valori sono riferiti a 1m3 di gas a T=300K, P=100kPa, n=40,09mol.
I punti in cui il calore scambiato è positivo sono relativi al calore fornito al gas, i punti in cui il calore scambiato è negativo sono relativi al calore perso dal gas.
Il primo grafico evidenzia il fatto che il volume non varia in modo lineare con il calore scambiato, ma ha invece un andamento di tipo esponenziale (del tipo y=ex).
Il secondo grafico evidenzia il fatto che la pressione non varia in modo lineare con il calore scambiato, ma ha invece un andamento di tipo esponenziale inverso (del tipo y=e-x).
I grafici presentati di seguito mostrano i valori effettivi del volume e della pressione.
Il primo grafico evidenzia il fatto che il volume non varia in modo lineare con il calore scambiato, ma ha invece un andamento di tipo esponenziale (del tipo y=ex).
Il secondo grafico evidenzia il fatto che la pressione non varia in modo lineare con il calore scambiato, ma ha invece un andamento di tipo esponenziale inverso (del tipo y=e-x).
I grafici presentati di seguito mostrano i valori effettivi del volume e della pressione.
Il primo grafico evidenzia nuovamente il fatto che il volume non varia in modo lineare con il calore scambiato, ma ha invece un andamento di tipo esponenziale (del tipo y=ex+Costante).
Il secondo grafico evidenzia il fatto che la pressione non varia in modo lineare con il calore scambiato, ma ha invece un andamento di tipo esponenziale inverso (del tipo y=e-x+Costante).
La trasformazione isoterma in un diagramma P-V è rappresentata da un tratto curvo di tipo iperbolico.
Partendo dall'equazione di stato dei gas perfetti
P * V = n * R * T
si arriva immediatamente a
P = n * R * T / V
dove il termine n * R * T è costante per le trasformazioni isoterme quindi l'equazione assume la forma semplificata
P = costante / V
A parità di stato iniziale, cioè a parità di P, V, n e T, e a parità di calore scambiato, la lunghezza della curva è indipendente dal tipo di gas.
Di seguito sono state graficate due trasformazioni isoterme.
Quella che si sviluppa dal punto iniziale verso sinistra è una compressione isoterma con cessione di 100kJ di calore; l'altra è una espansione isoterma con assorbimento di 100kJ.
Il secondo grafico evidenzia il fatto che la pressione non varia in modo lineare con il calore scambiato, ma ha invece un andamento di tipo esponenziale inverso (del tipo y=e-x+Costante).
La trasformazione isoterma in un diagramma P-V è rappresentata da un tratto curvo di tipo iperbolico.
Partendo dall'equazione di stato dei gas perfetti
P * V = n * R * T
si arriva immediatamente a
P = n * R * T / V
dove il termine n * R * T è costante per le trasformazioni isoterme quindi l'equazione assume la forma semplificata
P = costante / V
A parità di stato iniziale, cioè a parità di P, V, n e T, e a parità di calore scambiato, la lunghezza della curva è indipendente dal tipo di gas.
Di seguito sono state graficate due trasformazioni isoterme.
Quella che si sviluppa dal punto iniziale verso sinistra è una compressione isoterma con cessione di 100kJ di calore; l'altra è una espansione isoterma con assorbimento di 100kJ.
Una considerazione fondamentale è che nella trasformazione isoterma è presente il lavoro di volume (con segno positivo se lavoro fatto dal gas, con segno negativo se lavoro subito dal gas). Il suo valore nel diagramma P-V è rappresentato dall'area sottesa dalla curva di trasformazione (l'area rossa per la compressione isoterma, l'area verde per l'espansione isoterma).
Matematicamente, l'area sottesa da una curva si calcola con l'operazione di integrale e nel caso specifico si scrive come segue
Lespansione isoterma = n * R * T * ln ( Vfinale / Viniziale ) = 40,09 mol * 8,314 J mol-1 K-1 * 300 K * ln ( 2,718 m 3/1 m 3 ) = 100kJ = Q
Lcompressione isoterma = n * R * T * ln ( Vfinale / Viniziale ) = 40,09 mol * 8,314 J mol-1 K-1 * 300 K * ln ( 0,368 m 3/1 m 3 ) = -100kJ = Q
In una espansione isoterma il calore fornito viene trasformato integralmente in lavoro fatto dal gas.
In una compressione isoterma è il lavoro fatto sul gas che viene convertito integralmente in calore dissipato.
Per quanto sopra deriva che l'energia termica di un gas è costante in una trasformazione isoterma.
L'isoterma è una trasformazione in cui le uniche forme di energia coinvolte sono il calore scambiato e il lavoro di volume.
Nell'espansione isoterma (o anche depressurizzazione isoterma), l'energia fornita al gas sottoforma di calore viene completamente convertita in lavoro di volume.
Nella compressione isoterma (o anche pressurizzazione isoterma), il gas riceve energia sottoforma di lavoro dall'esterno e la dissipa integralmente sottoforma di calore.
Matematicamente, l'area sottesa da una curva si calcola con l'operazione di integrale e nel caso specifico si scrive come segue
Lespansione isoterma = n * R * T * ln ( Vfinale / Viniziale ) = 40,09 mol * 8,314 J mol-1 K-1 * 300 K * ln ( 2,718 m 3/1 m 3 ) = 100kJ = Q
Lcompressione isoterma = n * R * T * ln ( Vfinale / Viniziale ) = 40,09 mol * 8,314 J mol-1 K-1 * 300 K * ln ( 0,368 m 3/1 m 3 ) = -100kJ = Q
In una espansione isoterma il calore fornito viene trasformato integralmente in lavoro fatto dal gas.
In una compressione isoterma è il lavoro fatto sul gas che viene convertito integralmente in calore dissipato.
Per quanto sopra deriva che l'energia termica di un gas è costante in una trasformazione isoterma.
L'isoterma è una trasformazione in cui le uniche forme di energia coinvolte sono il calore scambiato e il lavoro di volume.
Nell'espansione isoterma (o anche depressurizzazione isoterma), l'energia fornita al gas sottoforma di calore viene completamente convertita in lavoro di volume.
Nella compressione isoterma (o anche pressurizzazione isoterma), il gas riceve energia sottoforma di lavoro dall'esterno e la dissipa integralmente sottoforma di calore.